Periode adalah satu baris
horizontal pada Sistem Periodik Unsur (SPU). Periode
dalam SPU diatur di dalam serangkaian baris, sehingga unsur yang
memiliki sifat-sifat mirip muncul dalam satu kolom. Unsur-unsur pada periode
yang sama memiliki jumlah kulit elektron yang sama; dengan masing-masing
perpotongan golongan di sepanjang periode, unsur memiliki satu tambahan
proton dan elektron dan berkurang sifat logamnya. Pengaturan ini mencerminkan
keberulangan sifat yang sama secara periodik seiring dengan kenaikan nomor
atom. Misalnya, logam alkali terletak pada satu golongan (IA) dan berbagai
sifat yang mirip, seperti reaktivitas yang tinggi dan kecenderungan untuk
kehilangan satu elektron agar sesuai dengan konfigurasi elektron gas mulia.
Tabel periodik memiliki total 118 unsur.
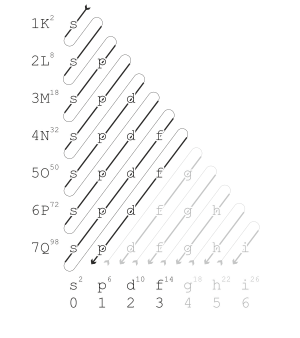
Kaidah pengurutan energi
Madelung menjelaskan urutan orbital yang disusun berdasarkan kenaikan
energi sesuai kaidah Madelung. Masing-masing diagonal merujuk pada nilai n + l
yang berbeda.
Mekanika kuantum modern
menjelaskan trend periodik sifat-sifat dalam hal kulit elektron. Seiring dengan
kenaikan nomor atom, kulit elektron terisi dengan elektron dengan urutan
seperti ditunjukkan oleh diagram orbital di atas. Mengisi setiap kulit sesuai dengan baris
dalam tabel.
(adsbygoogle = window.adsbygoogle || []).push({});
Dalam blok s dan blog p,
unsur-unsur dalam periode yang sama umumnya tidak menunjukkan trend dan
kesamaan sifat (lebih signifikan trend vertikal ke bawah dalam golongan). Namun
dalam blok d, trend sepanjang periode menjadi signifikan, dan dalam blok f,
unsur-unsur menunjukkan tingkat kesamaan yang tinggi di sepanjang periode.
Tujuh periode unsur terjadi
secara alami di Bumi. Untuk periode 8, yang mencakup unsur-unsur yang dapat
disintesis setelah 2015. Terdapat 7 periode, yang disusun horizontal di tabel
periodik.
Periode 1
Periode 1 merupakan periode yang paling sedikit anggotanya, dengan hanya 2 unsur, yaitu hidrogen (H dengan nomor atom = 1) dan helium (He dengan nomor atom = 2). Oleh karena itu, mereka tidak mengikuti kaidah oktet. Secara kimia, helium berperilaku sebagai gas mulia, dan oleh karenanya dimasukkan sebagai bagian dari gas mulia (golongan 18 atau VIIIA). Namun, dalam hal struktur intinya, helium masuk ke dalam blok s, dan oleh karena itu kadang-kadang diklasifikasikan ke dalam unsur golongan 2, atau secara simultan masuk ke dua golongan sekaligus golongan 2 dan 18. Hidrogen sangat mudah kehilangan dan menangkap sebuah elektron, dan oleh karena itu secara kimia masuk ke dalam dua golongan sekaligus yaitu unsur golongan 1 dan 17.
- Hidrogen (H) merupakan unsur paling melimpah, perhitungan kasar sekitar 75% dari massa unsur jagat raya. Ion hidrogen hanyalah sebuah proton. Bintang dalam urutan utama sebagian besar tersusun dari hidrogen pada tingkat plasmanya. Unsur hidrogen relatif jarang di bumi, dan secara industri diproduksi dari hidrokarbon seperti metana. Hidrogen dapat membentuk senyawa-senyawa dengan sebagian besar unsur dan terdapat dalam air serta sebagian besar senyawa organik.
- Helium (He) hanya hadir dalam kondisi gas, kecuali dalam kondisi ekstrem. Ia merupakan unsur kedua terringan dan juga peringkat kedua kelimpahan di alam semesta. Sebagian besar helium terbentuk selama ledakan dahsyat, tetapi helium baru tercipta melalui fusi nuklir hidrogen dalam bintang. Di bumi, helium relatif jarang, hanya muncul sebagai produk samping peluruhan alami beberapa unsur radioaktif.
Periode 2
Periode 2 terdiri dari 8 unsur. Unsur-unsur periode 2 melibatkan orbital 2s dan 2p. Beberapa unsur dalam periode ini merupakan unsur esensial secara biologi selain hidrogen, yaitu karbon, nitrogen, dan oksigen.
- Litium (Li) adalah logam paling ringan dan unsur padat paling rendah massa jenisnya. Dalam kondisi tak terionisasi, ia merupakan salah satu unsur paling reaktif, sehingga di alam hanya dapat ditemukan sebagai senyawanya.
- Berilium (Be) adalah logam ringan dengan titik lebur tertinggi. Sejumlah kecil berilium terbentuk selama Ledakan Dahsyat, meskipun sebagian besar kemudian meluruh atau bereaksi lebih lanjut di dalam bintang membentuk inti atom yang lebih besar, seperti karbon, nitrogen, atau oksigen. Berilium diklasifikasikan oleh Badan Internasional Penelitian Kanker (International Agency for Research on Cancer, IARC) sebagai karsinogen golongan 1. Antara 1% - 15% orang peka terhadap berilium dan dapat menyebabkan reaksi inflamasi pada sistwm pernapasan dan kulit, yang disebut penyakit berilium kronis.
- Boron (B) tidak terdapat secara alami sebagai unsur bebas, tetapi dalam senyawa seperti borat. Ia merupakan zat hara (micronutrient) esensial bagi tumbuhan, yang diperlukan sebagai kekuatan dan pengembangan dinding sel, pembelahan sel, pertumbuhan bibit dan buah, transportasi gula dan pengembangan hormon, meskipun bersifat toksik pada dosis tinggi.
- Karbon (C) adalah unsur peringkat keempat paling melimpah di jagat raya berdasarkan massanya, setelah hidrogen, helium dan oksigen. Juga merupakan unsur kedua paling melimpah dalam tubuh manusia setelah oksigen, peringkat tiga paling melimpah berdasarkan nomor atom. Jumlah senyawa yang mengandung karbon hampir tak terhingga karena kemampuan karbon untuk membentuk rantai panjang yang stabil melalui ikatan C—C. Seluruh senyawa oganik yang esensial bagi kehidupan, mengandung sekurang-kurangnya satu atom karbon; yang bersanding dengan hidrogen, oksigen, nitrogen, belerang dan fosfor, karbon adalah dasar dari setiap senyawa biologi penting.
- Nitrogen (N) dijumpai sebagian besar sebagai gas inert diatomik, N2, yang menyusun hingga 78% atmosfer bumi. Ini merupakan komponen esensial protein, dan oleh karenanya esensial pula bagi kehidupan.
- Oksigen (O) menyusun 21% atmosfer dan diperlukan untuk respirasi oleh hampir seluru hewan, dan merupakan komponen pembentuk air. Oksigen adalah unsur paling melimpah ketiga di alam semesta, dan senyawa oksigen mendominasi susunan kerak bumi.
- Fluor (F) adalah unsur paling reaktif dalam kondisi tak-terionisasi, sehingga tidak pernah ditemukan sebagai unsur di alam.
- Neon (Ne) adalah gas mulia yang digunakan dalam lampu neon.
Periode 3
Periode 3 terdiri dari 8 unsur. Seluruh unsur periode tiga terdapat di alam dan sekurang-kurangnya memiliki satu isotop stabil. Selain gas mulia Argon, semuanya merupakan unsur esensial untuk biologi dan geologi.
- Natrium (Na) adalah sebuah logam alkali. Ia terdapat dalam samudera di Bumi dalam jumlah besar dan hadir sebagai natrium klorida (garam meja).
- Magnesium (Mg) adalah logam alkali tanah. Ion magnesium ditemukan dalam klorofil.
- Aluminium (Al) adalah logam pasca transisi. Ia merupakan logam paling melimpah dalam kerak bumi.
- Silikon (Si) adalah metaloid. Ia bersifat semikonduktor, menjadikannya komponen utama dalam banyak sirkuit terpadu (IC). Silikon dioksida adalah konstituen utama pasir. Seperti pentingnya karbon untuk biologi , Silicon penting untuk geologi.
- Fosforus (P) adalah nonlogam esensial untuk DNA. Ia sangat reaktif, dan oleh karenanya tidak pernah dijumpai di alam sebagai unsur bebas.
- Belerang (S) adalah nonlogam. Ia dijumpai dalam dua asam amino, sistein dan metionin.
- Klorin (Cl) adalah halogen. Ia digunakan sebagai desinfektan, terutama dalam kolamrenng.
- Argon (Ar) adalah suatu gas mulia, menjadikannya hampir sepenuhnya tidak reaktif. Lampu pendar sering diisi dengan gas mulia seperti argon untuk menjaga filamen pada temperatur tinggi.
Periode 4
Periode 5
Periode 5 terdiri dari 18 unsur, dimulai dari rubidium (Rb) dan diakhiri oleh xenon (Xe). Unsur yang memiliki peran biologis bagi manusia paling berat hanyalah molebdenum dan iodin. Periode ini juga meliputi taknesium, unsur radioaktif paling ringan.
Periode 6
Periode 7
Periode 7 terdiri dari 32 unsur, dimulai dari fransium (Fr) dan diakhiri oleh oganeson (Og). Seluruh unsur periode 7 bersifat radioaktif. Periode ini mengandung unsur terberat yang secara alami ada di bumi, plutoium. Semua unsur setelahnya dalam periode ini telah disintesis secara artifisial. Sementara salah satu dari ini (einsteinium) saat ini tersedia dalam jumlah makroskopis, sebagian besar sangat jarang, dan hanya disintesis dalam jumlah mikrogram atau kurang. Beberapa unsur terakhir belum diidentifikasi di laboratorium dalam jumlah beberapa atom dalam waktu yang bersamaan.
Meskipun jarangnya unsur-unsur ini menandakan hasil percobaan tidak ekstensif, tren perilaku periodik dan golongan tampaknya kurang terdefinisi dengan baik untuk periode 7 dibandingkan periode lainnya. Sementara fransium dan radium menunjukkan sifat-sifat seperti golongan 1 dan 2, aktinida menunjukkan variasi perilaku dan tingkat oksidasi yang amat besar dibandingkan lantanida. Anomali periode 7 ini mungkin diakibatkan oleh beragam faktor, termasuk di antaranya besarnya tingkat pasangan spin-orbit dan efek relativistik. Dugaan terakhir, ini akibat dari tingginya muatan positif dari inti atom mereka yang masif.
Periode 8
Periode 8 kemungkinan terdiri dari 50 atau 54 unsur, dimulai dari ununennium (Uue) dan diakhiri oleh unheksoktium (Uho) (Z = 168) atau unseptbium (Usb) (Z = 172). Belum ada unsur dalam periode 8 yang berhasil disintesis. Blog-g adalah sebuah prediksi. Belum jelas apakah semua unsur yang diprediksi berada pada periode 8 secara fakta memungkinkan ada secara fisik.
Sumber : https://p2k.stekom.ac.id/ensiklopedia/Periode_tabel_periodik

Tidak ada komentar:
Posting Komentar